A Pfizer/BioNTech enviou neste sábado (6/2) à Agência Nacional de Vigilância Sanitária (Anvisa) o pedido para o registro definitivo da vacina COMIRNATY, contra a covid-19. A empresa é a segunda farmacêutica a avançar dessa forma no Brasil. A primeira foi a Fundação Oswaldo Cruz (Fiocruz) com a vacina de Oxford.
Quando finalizado, o registro concedido pela Anvisa será o sinal verde para que a vacina seja comercializada, distribuída e utilizada pela população, nos termos da indicação estabelecida na bula.
A farmacêutica anunciou que sua vacina contra a covid-19 é segura e tem 95% de eficácia. A vacina foi testada em 43,5 mil pessoas de seis países e, em setembro, a Anvisa (Agência Nacional de Vigilância Sanitária) autorizou que seus testes clínicos fossem ampliados no Brasil, de mil para dois mil testes em voluntários. Os testes foram feitos em São Paulo e Bahia.
O Brasil adquiriu, até o momento, 46 milhões de doses da vacina do Instituto Butantan em parceria com a farmacêutica Sinovac, com opção de compra de mais 54 milhões. O país recebeu também, da Índia, 2 milhões de doses da Astrazeneca, com opção de importação de mais doses, além de previsão de produção, pela Fundação Oswaldo Cruz (Fiocruz), de 100,4 milhões de doses no primeiro semestre e 110 milhões de doses no segundo semestre.
Há ainda, segundo o ministério, a possibilidade de aquisição de 42,5 milhões de doses pelo mecanismo Covax Facility, articulado pela Organização Mundial da Saúde (OMS).

 Óculos Programa Miguilim amplia acesso à saúde ocular de crianças e adolescentes em Minas
Óculos Programa Miguilim amplia acesso à saúde ocular de crianças e adolescentes em Minas  Corrida Serra de Santa Helena recebeu mais uma edição do Corrida Por Elas pelo fim da violência contra a mulher
Corrida Serra de Santa Helena recebeu mais uma edição do Corrida Por Elas pelo fim da violência contra a mulher  Aedes aegypti Levantamento aponta como de médio risco o nível de infestação do Aedes aegypti em Sete Lagoas
Aedes aegypti Levantamento aponta como de médio risco o nível de infestação do Aedes aegypti em Sete Lagoas  Atendimento Carreta Saúde Itinerante está em Sete Lagoas para realizar mais de 1.200 exames e consultas
Atendimento Carreta Saúde Itinerante está em Sete Lagoas para realizar mais de 1.200 exames e consultas  Imunização Vacimóvel estará nesta semana nos bairros Santa Rosa e Fazenda Velha em Sete Lagoas
Imunização Vacimóvel estará nesta semana nos bairros Santa Rosa e Fazenda Velha em Sete Lagoas  Imunização Dia D de Vacinação ocorre neste sábado nas cidades de Minas
Imunização Dia D de Vacinação ocorre neste sábado nas cidades de Minas  Doação de sangue HNSG de Sete Lagoas reforça a importância da doação de sangue
Doação de sangue HNSG de Sete Lagoas reforça a importância da doação de sangue  Policlínica Obras de nova Policlínica e de duas UBSs devem começar até fevereiro em Sete Lagoas
Policlínica Obras de nova Policlínica e de duas UBSs devem começar até fevereiro em Sete Lagoas 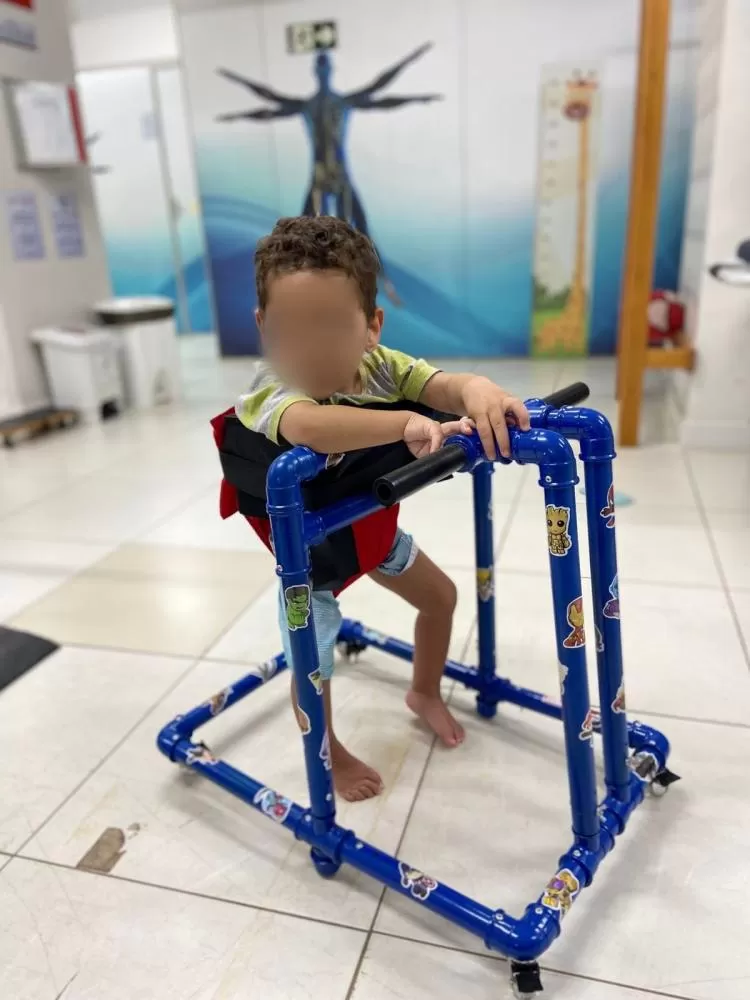 Andador/parapódio Sete Lagoas: Criança com suspeita de paralisia cerebral já utiliza andador produzido por estudantes da FACSETE
Andador/parapódio Sete Lagoas: Criança com suspeita de paralisia cerebral já utiliza andador produzido por estudantes da FACSETE Mín. 18° Máx. 31°





